Revista Cubana de Medicina Intensiva y Emergencia 2014;13(4)
Multirresistencia antimicrobiana en unidades de cuidados intensivos: alerta roja
Antimicrobial multiresistance in intensive care units: red alert
Dr. C. Anselmo A. Abdo Cuza*
*Doctor en Ciencias. Especialista de segundo grado en Medicina Intensiva y Emergencias. Especialista de primer grado en Medicina Interna. Profesor Titular.
Centro de Investigaciones Medico Quirúrgicas (CIMEQ). La Habana. Cuba.
"El mundo se está dirigiendo hacia una era postantibiótico, en la cual muchas infecciones comunes ya no podrán curarse y, una vez más, comenzarán a matar con toda su fuerza" Margaret Chan, Directora General de la Organización Mundial de la Salud.
La multirresistencia antimicrobiana ha emergido como un problema sanitario mundial que requiere de máxima atención. En 2014, la Organización Mundial de la Salud (OMS) publica su primer informe global sobre las amenazas de la resistencia a los antibióticos1. La OMS alertó de esta grave situación que puede poner en peligro los logros de la medicina moderna.
Entre los microorganismos más frecuentes que han adquirido mecanismos defensivos se encuentran las enterobacterias (fundamentalmente Klebsiella pneumoniae y Escherichia coli) y los bacilos gram negativos no fermentadores (Acinetobacter baumanii y Pseudomonas aeruginosa), y son precisamente estos quienes ocupan los primeros lugares como agentes causales de las infecciones relacionadas con el cuidado sanitario (IRCS) en nuestras unidades de cuidados intensivos (UCIs)2.
Los factores de riesgo descritos para la adquisición de microorganismos multirresistentes (multidrug resistance: MDR) son condiciones sine qua non de todo enfermo grave en UCIs3,4.
Son múltiples los mecanismos de resistencia que poseen estas bacterias, unos intrínsecos y otros adquiridos; enzimas inactivantes (betalactamasas, carbapenemasas), mutación de porinas, bomba de expulsión activa, mutación de sitios de acción, entre otros, los cuales pueden presentarse de forma aislada, o con frecuencia combinados potenciando la multirresistencia5.
En noviembre de 2011 la Organización Panamericana de la Salud (OPS) emitió una alerta epidemiológica por aislamientos en Guatemala de cepas de Klebsiella pneumoniae con el mecanismo de resistencia antimicrobiana, denominado New Delhi Metalobetalactamasa (NDM). En noviembre de 2012 Paraguay notificó el hallazgo de carbapenemasas del tipo NDM en aislamientos de Acinetobacter baumanii en pacientes hospitalizados,y en diciembre de 2012 se emite una segunda alerta epidemiológica por la transmisión de microorganismos MDR tipo NDM en servicios de salud6.
En nuestro país, Espinosa et al7 en el Hospital Hermanos Ameijeiras,en un estudio comparativo de los patrones de susceptibilidad microbiana realizado entre los años 2002 y 2006, muestran en el último año predominio del aislamiento de bacterias gram negativas y en particular, bacilos no fermentadores como Acinetobacter spp y Pseudomonas spp, con un incremento de los patrones de resistencia. Se demostró Escherichia coli resistente a Ciprofloxacina (71 % para el hospital y 85.71 % para la UCI), yAcinetobacter spp resistente a Meropenem (55 % y 62 % respectivamente). Cuatro años después en ese mismo centro Hart et al encontraban patrones de resistencia muy elevados para Acinetobacter baumanii, 92.5 % frente a Cefepime, 95 % para Ciprofloxacina y 90 % frente a Meropenem8.
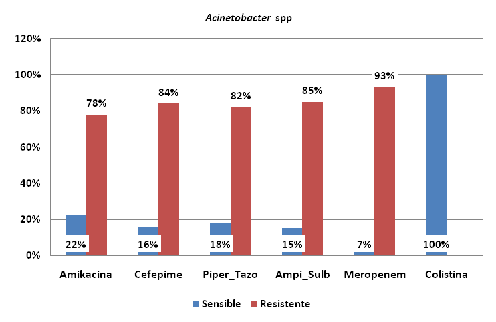
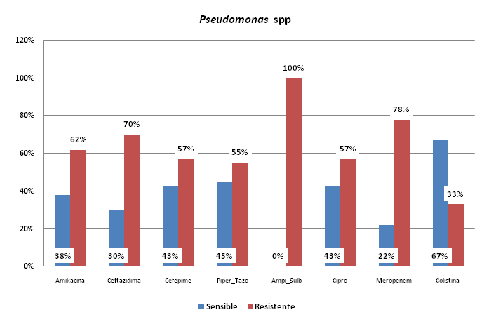
En un estudio multicentrico9 (Proyecto Disminución de la Infección Nosocomial en Unidades de Cuidados Intensivos: DINUCIs) donde participaron 16 UCIs cubanas para caracterizar la incidencia de las principales IRCS, yaun con las limitantes de no haber certificado todos los aislamientos por un centro de referencia y la no disponibilidad homogénea de recursos microbiológicos, se encuentra en el 2013 una alta resistencia antimicrobiana, situación que se muestra en la figuras 1 y figura 2, en relación con los patrones de susceptibilidad de Acinetobacter spp y Pseudomonas spp.
A inicios de 2014 Quiñones et al10 detectan por vez primera en Cuba, tres aislamientos de Klebsiella pneumoniae productoras de carbepenemasas (tipo KPC). Dos de los tres pacientes se encontraban ingresados en UCIs de dos regiones del país, distantes entre sí.
Este problema sanitario tiene consecuencias negativas para indicadores de resultado y calidad, como quedó en evidencia en el DINUCIs tercera fase9. La mortalidad de los pacientes con IRCS fue 41.07 % vs 17.76 % en pacientes sin ellas (p ˂ 0.001). La estadía media de los pacientes con IRCS fue 11.25 días (±7. 9) vs 4.75 días (±4.2) de pacientes sin ellas (p ˂ 0.001).
Aunque cada centro tiene características particulares y distintos mapas microbiológicos considero oportuno hacer algunos comentarios desde los cuidados intensivos sobre esta situación real, mundial y nacional. Los pacientes con infecciones graves por estos microorganismos MRD van a la UCI o surgen en ellas. A pacientes con estas características se refiere este artículo.
Las estrategias para al menos intentar disminuir el problema parten de reconocerlo como problema sanitario. El enfoque debe ser multidisciplinario. Una correcta política antibiótica tanto hospitalaria como comunitaria es vital. La adecuada y homogénea microbiología es básica. La higiene y la epidemiologia imprescindibles.
Ha existido cierta controversia sobre el tratamiento de microorganismos MDR con regímenes combinados o monoterapia. La justificación al tratamiento con monoterapia es atractiva pero el consenso se inclina (por unanimidad de la evidencia) al tratamiento combinado para las infecciones graves11-13.
A día de hoy aun con un antibiograma que nos informe resistencia a Meropenem de Acinetobacter spp, la evidencia indica tratamiento antibiótico combinado y de primera elección Meropenem (u otro carbapenémico de acuerdo al caso). La administración debe ser en un régimen de infusión prolongada (en tres horas) y en dosis máxima. El o los otros antibióticos que formaran parte del tratamiento combinado debe ser guiado por antibiograma. Las opciones no son muchas, generalmente debe valorarse: Colistina, Tigeciclina, Fosfomicina, Amikacina, Levofloxacina o Rifampicina, los que se recomiendan siempre usar como parte de una terapia combinada y en las dosis adecuadas14.
Es apremiante para nuestras UCIs disponer de la determinación de concentración inhibitoria mínima (CIM) y orientarnos hacia los mecanismos de resistencia. Existen algunos autores que justifican el uso de carbapenémicos solo si la CIM para meropenem o imipenem del organismo infectante es ≤8mg/l.
La utilización de los antibióticos debe ser óptima en cuanto a dosis y formas de administración. Con respecto a Colistina (hasta el momento, la tabla de salvación) una encuesta internacional15 ha puesto en evidencia lo heterogéneo de su uso, sin embargo la mayoría de los expertos recomiendan el uso de una dosis de carga de 9 millones UI, seguida de la administración de 4.5 millones UI cada 12 horas en pacientes con función renal conservada (definida como creatinina < 1.2 mg/dl o filtrado glomerular [FG] >50ml/min/1.73 m2SC). Para pacientes con FG < 50 y > 20 ml/min utilizar una dosis de mantenimiento de 4.5 millones UI en 24 horas, mientras que aquellos con aclaramiento de creatinina <20 ml/min recibirán 4.5 millones UI en 48 horas. La dosis de carga de 9 millones UI debe ser utilizada aun con disminución de la función renal.
Es necesario conocer las equivalencias de las distintas presentaciones de Colistina, así tenemos que, 1 mg colistin base activity (CBA) equivale a 33.250 UI. Para colistimethate sodium (CMS), 1 mg equivale a 12.500 UI. Por lo tanto 9 millones UI equivale a 720 mg CMS15. La presentación que recibimos en el país, es de 100 mg de colistina base que equivale a 240 mg de CMS y a 3 millones UI. Se sugiere revisar cada presentación disponible.
Las estrategias higiénico epidemiológicas en la UCI para evitar la propagación una vez identificado algún microorganismo multirresistente parten de la formación de un bloque monolítico entre médicos, enfermeras, auxiliares y epidemiólogos. Las medidas a implementar se muestran en el cuadro 1.
Resulta interesante que de forma paradójica son viejos antimicrobianos quienes tienen las mejores sensibilidades contra los microorganismos MDR, de igual forma recordar la célebre observación de Semmelweis sobre el lavado de manos.
La medida más efectiva para este problema es la prevención. En 2013 el grupo de investigadores del Proyecto DINUCIs realizó un consenso9 para establecer las medidas de prevención para las principales IRCS en UCIs,las adoptadas se presentan en el cuadro 2.
Desde los cuidados intensivos prevenir y vigilar son estrategias básicas en esta batalla. Los microorganismos MDR aunque con admirables estrategias defensivas requieren de nuestras (malas) acciones para su diseminación.
Referencias bibliográficas
ANEXOS
Cuadro 1. Estrategia higiénica epidemiológica en unidades de cuidados intensivos para evitar la propagación de microorganismo multirresistentes.
1. Habitación individual, si no es posible se realiza aislamiento de cohorte (pacientes con igual microorganismo pueden compartir la habitación).
2. Usar siempre guantes limpios no estériles antes de cualquier contacto con el paciente o su entorno y desecharlos.
3. Aplicación de solución alcohólica antes de colocarse y después de retirarse los guantes. Ideal disponer de dispensadores y secado con papel o servilletas.
4. Usar equipamiento de protección personal (sobrebata, tapaboca, lentes) si se valora que en la atención se tendrá contacto con el paciente, fluidos orgánicos o instrumental.
5. Esfigmomanómetro, estetoscopio, termómetro y soluciones alcohólicas exclusivos para el paciente.
7. Bolsa para residuos en la habitación.
8. Bolsa para recolectar la ropa de cama en la habitación.
9. Artículos de limpieza exclusivos para la habitación.
10. Limitar los traslados del paciente.
11. El familiar debe aplicase solución alcohólica en las manos antes y después de la visita.
Cuadro 2. Consenso sobre paquete de medidas para la prevención de las principales Infecciones Relacionadas con el Cuidado Sanitarioen unidades de cuidados intensivos. Julio de 2013. Investigadores del Proyecto Disminución de Infecciones Nosocomiales en Unidades de Cuidados Intensivos (DINUCIs).
Medidas básicas
Medidas específicas que componen al paquete de medidas (requieren de control de adherencia).
Opcionales
Figura 1. Patrones de susceptibilidad de Acinetobacter spp. (Proyecto DINUCIs 2013)

Figura 2. Patrones de susceptibilidad de Pseudomonas spp. (Proyecto DINUCIs 2013)
Recibido: 04 de noviembre de 2014
Aprobado: 08 de noviembre de 2014
Anselmo A. Abdo Cuza. Centro de Investigaciones Medico Quirúrgicas (CIMEQ). La Habana. Cuba. Dirección electrónica: aaabdo@infomed.sld.cu